实验室制取氧气的方法是什么?
在化学实验室中,制取氧气是一项基础且重要的实验。氧气,化学式为O₂,相对分子质量为32.00,是一种无色无味的气体,也是氧元素最常见的单质形态。它的熔点为-218.4℃,沸点为-183℃,不易溶于水,1L水中大约能溶解30mL氧气。实验室制取氧气有多种方法,以下是几种常见的方法,涵盖了化学原理、操作步骤以及注意事项,为读者提供一个全面的了解。

氯酸钾制取氧气
氯酸钾(KClO₃)是一种白色固体,可以通过加热与催化剂二氧化锰(MnO₂)反应制取氧气。这个反应的化学方程式为:
\[2KClO_3 \overset{\Delta \text{ }MnO_2}{=} 2KCl + 3O_2 \uparrow\]
操作步骤
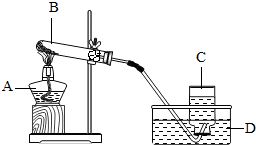
1. 装置选择:选择固固加热型装置,即固体与固体加热制气体的装置。
2. 检查装置气密性:确保装置连接紧密,防止气体泄漏。
3. 装入药品:将氯酸钾和二氧化锰的混合物装入试管底部。
4. 固定试管:将试管固定在铁架台上,试管口略向下倾斜,以防止冷凝水回流炸裂试管。
5. 加热:点燃酒精灯,对试管进行预热,然后固定在对药品处加热。
6. 收集气体:使用排水法或向上排空气法收集产生的氧气。
7. 停止加热:实验结束后,先将导管从水槽中取出(如果使用排水法),再熄灭酒精灯,防止水槽中的水倒吸入试管,使试管炸裂。
注意事项
试管口应放一团棉花,防止氯酸钾粉末进入导管。
导管应稍露出橡皮塞,便于气体排出。
加热时要均匀,避免试管因受热不均而炸裂。
高锰酸钾制取氧气
高锰酸钾(KMnO₄)是一种深紫色的结晶体,可以通过加热分解制取氧气。这个反应的化学方程式为:
\[2KMnO_4 \overset{\Delta}{=} K_2MnO_4 + MnO_2 + O_2 \uparrow\]
操作步骤
1. 装置选择:同样选择固固加热型装置。
2. 检查装置气密性:确保装置连接紧密。
3. 装入药品:将高锰酸钾装入试管底部。
4. 固定试管:将试管固定在铁架台上,试管口略向下倾斜。
5. 加热:点燃酒精灯,对试管进行预热,然后固定在对药品处加热。
6. 收集气体:使用排水法或向上排空气法收集氧气。
7. 停止加热:实验结束后,同样要先将导管从水槽中取出(如果使用排水法),再熄灭酒精灯。
注意事项
试管口应放一团棉花,防止高锰酸钾粉末进入导管。
加热时要均匀,避免试管炸裂。
排水法收集时,要等到气泡连续均匀冒出时再收集,以保证气体的纯度。
过氧化氢制取氧气
过氧化氢(H₂O₂),又称双氧水,在二氧化锰的催化下可以分解制取氧气。这个反应的化学方程式为:
\[2H_2O_2 \overset{MnO_2}{=} 2H_2O + O_2 \uparrow\]
操作步骤
1. 装置选择:选择固液不加热型装置,即液体与固体不加热制气体的装置。
2. 检查装置气密性:用夹子夹住导管,然后往长颈漏斗中加水,检查长颈漏斗颈部中的水柱是否下降,以判断装置的气密性。
3. 装入药品:先装固体二氧化锰,再注入过氧化氢溶液。
4. 收集气体:使用排水法或向上排空气法收集氧气。
注意事项
长颈漏斗的颈部应在液面以下,以防止气体从长颈漏斗泄露。
导管应稍露出橡皮塞,便于气体排出。
可以用带火星的木条检验氧气的存在,如果木条复燃,说明是氧气。
收集气体时,要等到气泡连续均匀冒出时再收集,以保证气体的纯度。
其他制取氧气的方法
除了上述三种常见的方法外,还有一些其他方法可以制取氧气,例如过氧化钠(Na₂O₂)与二氧化碳反应、超氧化钾(KO₂)与二氧化碳反应等。但这些方法相对复杂,不常用于初级化学实验教学。
总结
实验室制取氧气是化学实验中的一个重要
- 上一篇: 如何制作关于“珍爱生命,健康成长”的电子报?
- 下一篇: 轻松学会!千纸鹤折纸步骤图解,一看就会的折法
-
 百度区块链宠物:深入了解莱茨狗资讯攻略11-02
百度区块链宠物:深入了解莱茨狗资讯攻略11-02 -
 Amber爆料:男团女团定义新视角,我曾是实验品般的存在!资讯攻略03-12
Amber爆料:男团女团定义新视角,我曾是实验品般的存在!资讯攻略03-12 -
 家用制氧机:如何设定最适宜的氧浓度?资讯攻略11-23
家用制氧机:如何设定最适宜的氧浓度?资讯攻略11-23 -
 海岛奇兵:构建武器实验室指南资讯攻略12-07
海岛奇兵:构建武器实验室指南资讯攻略12-07 -
 炉石传说黑石山秘密实验室艾卓曼德斯英雄难度怎么打?资讯攻略11-04
炉石传说黑石山秘密实验室艾卓曼德斯英雄难度怎么打?资讯攻略11-04 -
 掌握温度计的正确读数方法资讯攻略11-21
掌握温度计的正确读数方法资讯攻略11-21











